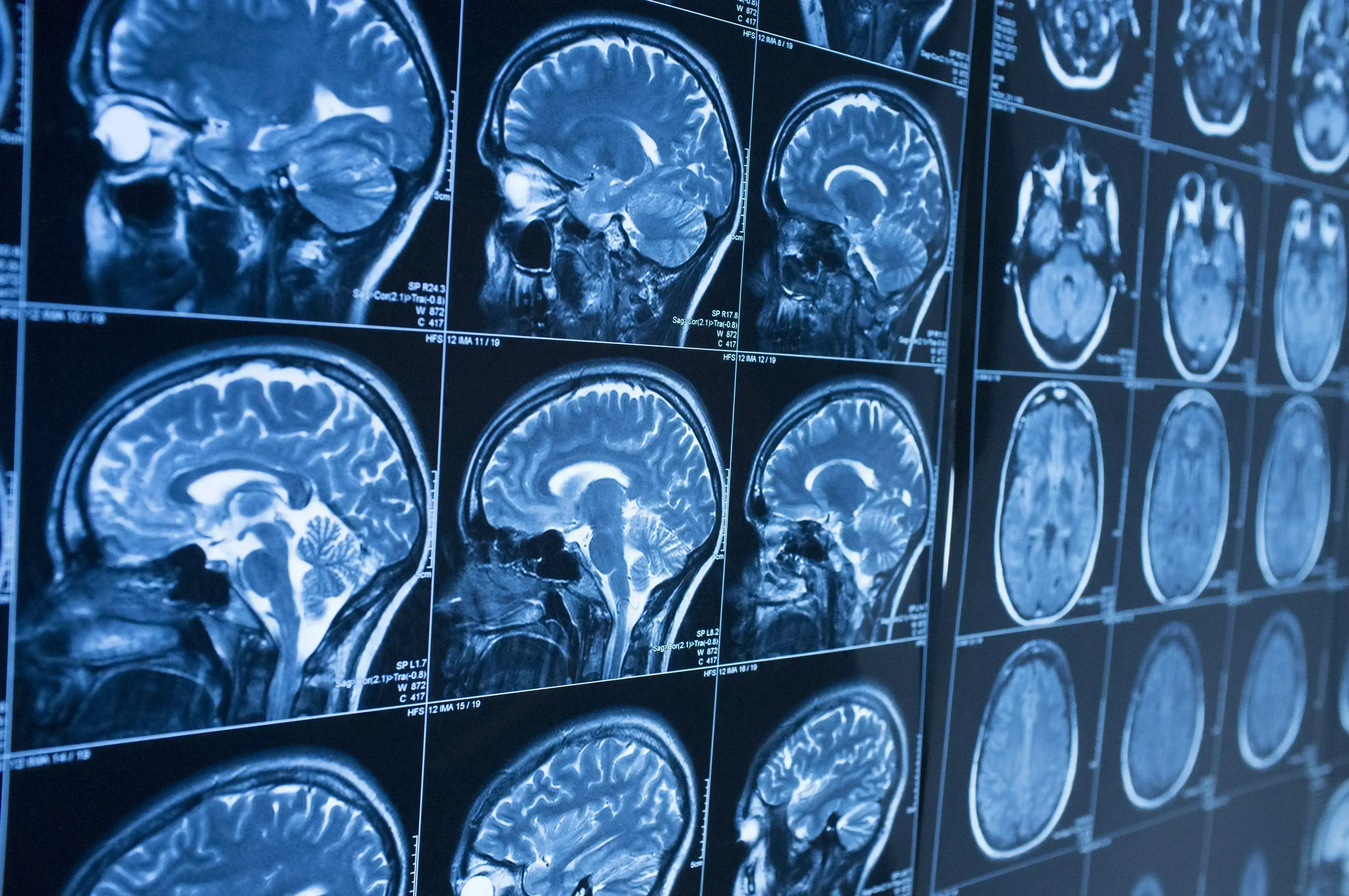
Tau-PET imaging in the clinic is on the horizon and would complement amyloid-PET and structural and functional MRI in our search for tools in the differential diagnosis and staging of dementias.
임상현장에서의 타우-PET 이미징 기술의 도입이 임박했습니다. 이 기술은 치매 감별진단 및 병기(staging) 분류를 위한 툴로써 아밀로이드-PET 및 구조적 및 기능적 MRI를 보완해 줄 것입니다.
Increasing severity of Alzheimer’s disease (AD) is associated with a progressive breakdown in anatomical brain connections that can be revealed by functional MRI.1 Such use of advanced imaging to map changes in the brain connectome was among several areas of progress picked out by Massimo Filippi (San Raffaele Scientific Institute, Milan, Italy) in the EAN 2020 Virtual Congress session devoted to news in neuroimaging.
알츠하이머병 중증도 심화는 해부학적인 점진적 뇌 연결의 붕괴와 관련되어 있으며, 이는 기능적 MRI로 밝혀낼 수 있습니다.1 EAN 2020 신경 영상 분야 동향에 관한 가상 회의 세션에서 마시모 필리피 교수(Massimo Filippi, 이탈리아 밀라노 산라파엘레과학연구소)는 관련 연구 분야의 발전 사례들을 소개하며, 그 중 하나로 이와 같은 뇌 연결 상태의 변화를 발견하기 위한 진보된 이미징 기술의 이용에 관해 설명했습니다.
The Milan group has already shown that -- in people with a similar degree of cognitive impairment -- functional MRI allows early-onset AD to be distinguished from behavioral variant frontotemporal dementia.2
밀라노 연구진의 기존 연구 결과에 따르면, 인지기능 장애 정도가 유사한 환자들을 대상으로 기능적 MRI를 이용하면 조발성 알츠하이머병과 행동변종 전두측두엽 치매를 구분해낼 수 있습니다.2
Increasing the field strength of MRI enhances detection of amyloid plaques
MRI의 자기장 강도를 높이면 아밀로이드 플라크 검출능이 증대됩니다
In other developments, use of ultra high-field MRI has now been shown to increase the detection of amyloid plaques that are evident post mortem. The ability to image pathology at high spatial resolution may offer a new means for the in vivo assessment of amyloid load in patients with AD.
다른 개발 사례에서, 초고자장 MRI(ultra high-field MRI)의 활용은 아밀로이드 플라크 검출능을 증대시켰으며, 이는 사후부검에서 확인되었습니다. 또한, 고공간 분해능(high spatial resolution)을 이용한 병리 이미징 기술은 알츠하이머병 환자의 체내 아밀로이드 부하 평가를 위한 새로운 방법으로 활용될 수 있습니다.
Machine learning applied to MRI
기계 학습을 MRI에 적용
Professor Filippi also drew attention to the growing role of deep learning through which artificial intelligence systems compare brain scans from normal controls and people with dementia to identify patterns that will refine diagnosis and prognosis.3
필리피 교수는 인공 지능 시스템으로 정상 집단과 치매 환자의 뇌 스캔을 비교하고 여기에서 나타나는 패턴의 차이를 파악해 진단 및 예후 측정 방법을 개선하기 위해 활용하는 딥 러닝 기술의 역할 증대에도 주목했습니다.3
In an addition to existing knowledge about the prognostic value of structural MRI, a study from the Alzheimer's Disease Neuroimaging Initiative (ADNI) shows that annual decrease in volume predicts conversion from mild cognitive impairment to AD only when baseline volume exceeds a certain threshold. This finding has implications clinically, but also for the use of atrophy rate as an endpoint in trials.4
구조적 MRI의 예후적 가치에 관한 기존 지식 외에도, 알츠하이머병 신경영상 이니셔티브(ADNI)가 실시한 한 연구에 따르면, 기저 부피가 일정 수준 이상인 경우 연간 감소하는 부피를 통해 경도 인지 장애에서 알츠하이머병으로의 진행을 예측할 수 있습니다. 이 연구 결과는 임상적으로 중요할 뿐만 아니라 임상 시험에서 위축 속도(atrophy rate)를 평가변수로 이용할 수 있다는 점에서도 의의가 있습니다.4
Tau as a driver of dementia
치매 동인으로서의 타우
In the same session, Alexander Drzezga (University of Cologne, Germany) discussed advances in amyloid and tau imaging. He reviewed recent evidence that higher amyloid load in people with subjective cognitive decline is associated with faster rate of deterioration in a range of cognitive domains5 – just as it predicts rate of decline in people who already have objective cognitive impairment.
한편, 해당 세션에서 알렉산더 드르체츠가 교수(Alexander Drzezga, 독일 쾰른대학교)는 아밀로이드 및 타우 이미징 기술의 발전에 대해 논했습니다. 드르체츠가 교수는 주관적 인지 기능 저하를 겪는 환자들에서 높은 아밀로이드 부하가 빠른 인지 영역의 퇴화와 관련되어 있음을 보여주는 최근의 연구 결과들을 리뷰했습니다.5 이는 이미 객관적 인지 장애를 겪고 있는 환자의 퇴화 속도를 예측하는 요인이기도 합니다.
The hope is that tau-PET reveals the location of developing atrophy as well as the nature of pathology
타우-PET를 통해 병리 뿐만 아니라, 위축이 일어나는 위치도 파악할 수 있을 것으로 기대됩니다
But Professor Drzezga noted that there is a high frequency of age-related amyloid pathology irrespective of cognitive status, and that many patients in the IDEAS (Imaging Dementia—Evidence for Amyloid Scanning) study in whom AD is being considered as a diagnosis do not have amyloid on PET scanning.6
그러나 드르체츠가 교수는 아밀로이드 병리가 인지 기능 상태와 관계없이 연령과 관련되어 있는 경우가 많으며, IDEAS(치매 이미징 - 아밀로이드 스캐닝 근거) 연구에서는 알츠하이머병으로 진단된 것으로 간주되는 여러 환자들의 PET 스캐닝 결과 아밀로이드가 발견되지 않았다는 점을 강조했습니다.6
He looked forward to an era in which tau-PET, though still experimental at present, provides clinically useful information about the location of neurodegeneration and complements evidence from amyloid-PET about neuropathological processes underlying dementia.
드르체츠가 교수는 아직 실험 단계이긴 하지만, 앞으로 타우-PET이 신경퇴행이 일어나는 위치에 대한 유용한 임상적 정보를 제공하고 치매의 신경병리적 과정에 대해 아밀로이드-PET 으로부터 나오는 근거를 보완할 수 있는 시대를 기대하고 있습니다.
In disease staging, tau may prove more useful than amyloid as a marker, he suggested, since amyloid accumulation -- which appears to begin far earlier than that of tau -- tends to reach a plateau before the onset of clinical progression.
병기 분류에 있어서 타우가 아밀로이드보다 마커로서의 유용성이 더 높을 수 있다고 드르체츠 교수는 제안했습니다. 아미로이드는 타우보다 훨씬 먼저 축적되기 시작하고 임상적 발병 이전에 정체 상태에 도달하는 경향이 있기 때문입니다.
Our correspondent’s highlights from the symposium are meant as a fair representation of the scientific content presented. The views and opinions expressed on this page do not necessarily reflect those of Lundbeck.
본 기사는 토론회에서 발표된 과학 지식 내용을 공정하게 전달하였습니다. 본 기사에서 제시된 의견은 룬드벡의 의견과 다를 수 있습니다.